Gliome diffus de bas grade
Qu’est-ce qu’un gliome diffus de bas grade ?
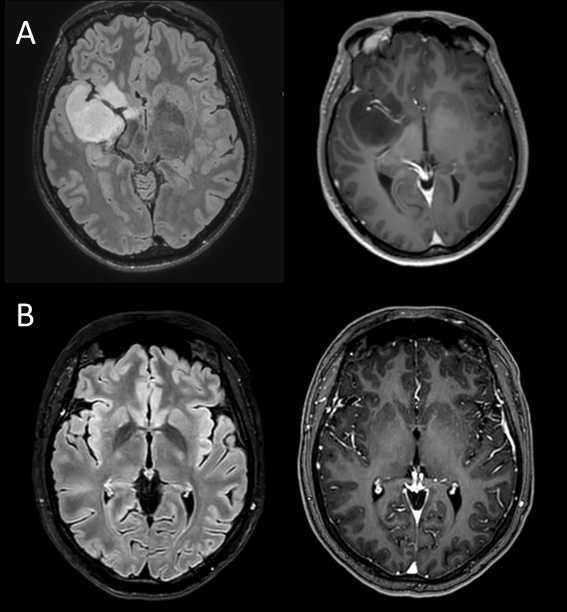
Les gliomes diffus de bas grade sont des tumeurs cérébrales primitives, c’est-à-dire des tumeurs qui se développent à partir des cellules de soutien présentes dans le cerveau (oligodendrocytes, astrocytes). On distingue deux grandes catégories de gliomes de bas grade : les oligodendrogliomes et les astrocytomes (dont la morphologie cellulaire reproduit respectivement celle des oligodendrocytes et celle des astrocytes). Au diagnostic, la plupart des patients ont un âge compris entre 20 ans et 40 ans.
Les gliomes diffus de bas grade sont des tumeurs d’évolution lente, dont le diamètre augmente en moyenne de 4 mm par an. En l’absence de prise en charge, au bout de plusieurs années d’évolution, les gliomes diffus de bas grade peuvent se transformer en gliomes de haut grade et évoluer alors beaucoup plus rapidement. Les gliomes diffus de bas grade peuvent se développer dans toutes les zones du cerveau mais sont le plus souvent localisés à proximité des aires de la motricité ou du langage, sans que l’on ne puisse, à l’heure actuelle, expliquer cette distribution.
Comment sont diagnostiqués les gliomes de bas grade ?
Les gliomes de bas grade peuvent être diagnostiqués dans différentes circonstances :
- Il peut s’agir d’une découverte fortuite, à l’occasion de la réalisation d’une IRM cérébrale pour une raison n’ayant pas de rapport avec la tumeur (exemple : bilan de maux de tête ou de vertiges)
- La découverte peut être consécutive à l’apparition de symptômes neurologiques. Il s’agit, le plus souvent, de crises d’épilepsie. Plus rarement, il peut s’agir d’un déficit neurologique (faiblesse d’un membre, troubles de la parole par exemple), ou de maux de tête si la tumeur est volumineuse.
Comment se déroule la prise en charge d'un gliome diffus de bas grade ?
Le dossier de chaque patient est discuté en réunion de concertation pluridisciplinaire (RCP), c’est-à-dire en présence de plusieurs médecins de spécialité différente et complémentaire : neurochirurgien, neurologue, neuroradiologue, radiothérapeute et anatomo-pathologiste.
Une prise en charge thérapeutique est proposée dans deux situations :
- Lorsque la croissance d’un gliome diffus de bas grade est confirmée radiologiquement,
- Lorsqu’un gliome diffus de bas grade est à l’origine de symptômes neurologiques, quelle qu’en soit la nature.
Lorsqu’elle est réalisable, l’ablation chirurgicale du gliome est la première étape du traitement. Dans la mesure où les gliomes diffus sont fréquemment localisés à proximité d’aires fonctionnelles (notamment motrices ou langagière), il est souvent proposé de réaliser l’exérèse en condition éveillée. Cette technique nécessite une expertise particulière et doit être réalisée par une équipe entraînée (chirurgien, anesthésiste, orthophoniste ou neuropsychologue). Elle permet de tester précisément les fonctions neurologiques pendant la chirurgie et donc d’identifier et de préserver les zones fonctionnelles (c’est-à-dire les zones qui sont essentielles pour parler, bouger, se déplacer…).
L’objectif d’une telle chirurgie est d’enlever la tumeur le plus complètement possible, tout en diminuant le risque de déficit neurologique irréversible post-opératoire, afin de permettre à chaque patient de reprendre une vie « normale ». Toutefois, une telle chirurgie peut être à l’origine d’un déficit neurologique transitoire et justifier une prise en charge rééducative, en kinésithérapie, en orthophonie ou en neuropsychologie.
La réalisation d’une chirurgie en condition veillée impose la réalisation d’un bilan pré-opératoire comprenant :
- Une évaluation orthophonique (pour les tumeurs latéralisées à gauche)
- Une évaluation neuro-psychologique
- Une IRM cérébrale fonctionnelle (IRM durant laquelle des tâches langagières ou motrices sont réalisées afin d’estimer la localisation des zones fonctionnelles)
- Un éventuel examen d’imagerie nucléaire
- Une évaluation en consultation d’anesthésie
En revanche, si le gliome de bas grade n’est pas localisé à proximité de zones fonctionnelles, il n’est pas nécessairement utile de réaliser des tests pendant la chirurgie et il est envisageable de réaliser cette dernière sous anesthésie générale.
Dans certains cas, il n’est pas possible de retirer la tumeur. Une biopsie tumorale sera alors réalisée dans le but d’obtenir un échantillon tumoral et de l’analyser afin de connaître précisément le diagnostic. Ces informations sont essentielles pour guider la suite de la prise en charge.
Comment se déroule la chirurgie ?
La chirurgie se déroule en 3 étapes :
- Abord de la tumeur : patient endormi
Une attention particulière est portée à l’installation qui doit être le plus confortable possible pour le patient. Il est à noter que, pour des raisons de sécurité, la tête est immobilisée dans un dispositif prévu à cet effet. Aucun mouvement de la tête n’est possible durant la chirurgie. Des médicaments anesthésiques sont injectés par voie veineuse et une anesthésie locale est réalisée au niveau du scalp. Alors que le patient est endormi, la peau du crâne est incisée. Ensuite, l’os et les méninges (enveloppes du cerveau) sont ouverts et le cerveau est exposé.
- Tests fonctionnels et exérèse de la tumeur
En condition éveillée : le patient est réveillé. Grâce à l’anesthésie, il n’y a pas de douleur. Une orthophoniste ou une neuropsychologue vient au bloc pour évaluer le patient.
Dans un premier temps, une cartographie est réalisée à la surface du cerveau. Le patient devient alors acteur de sa propre chirurgie. Alors qu’il réalise différentes tâches, des stimulations électriques à basse intensité sont réalisées et permettent de repérer les zones fonctionnelles impliquées dans les fonctions langagières, motrices et neuropsychologiques. Toutes les zones fonctionnelles identifiées seront soigneusement préservées par la suite.
Dans un deuxième temps, une fois que la cartographie est terminée, la réalisation de tests se poursuit pendant que le neurochirurgien retire la tumeur, afin de s’assurer que les zones fonctionnelles profondes sont également respectées. Le chirurgien s’aide d’un microscope opératoire.
Une fois cette seconde étape achevée, le patient est rendormi.
Chez les patients dont la tumeur n’est pas localisée en zone fonctionnelle, il n’y a aucun test à réaliser. Dans ce cas, l’ablation de la tumeur débute dès que l’abord est terminé. La technique chirurgicale est identique.
- Fermeture
La fermeture est réalisée sous anesthésie générale, plan par plan (fermeture étanche des méninges puis reconstruction osseuse puis fermeture cutanée). Habituellement, des agrafes sont mises en place sur la peau et seront à retirer 10 jours après la chirurgie.
Le lever est possible le lendemain de la chirurgie. Un bilan orthophonique, neuropsychologique, kinésithérapique et/ou ergothérapeutique est réalisé dans les jours qui suivent la chirurgie et avant la sortie, afin de donner les consignes qui guideront la rééducation, si celle-ci est nécessaire.
Quels sont les principaux risques opératoires ?
Les risques opératoires sont essentiellement dépendants de la localisation tumorale. Il existe aussi des risques en rapport avec les pathologies pré-existantes de chaque patient (troubles cardiaques, respiratoires, …).
- L’aggravation d’un déficit neurologique ou l’apparition d’un nouveau déficit neurologique (motricité, langage) est possible. Ce déficit est lié à l’ablation de zones fonctionnelles compensables et disparait au bout de quelques semaines, lorsque le cerveau s’est « réorganisé » (mise en œuvre de mécanismes de neuroplasticité). Une récupération complète est attendue à l’issue d’une prise en charge rééducative intensive pour une durée de 3 mois. Toutefois, le risque de déficit définitif (ne récupérant pas) ne peut jamais être totalement nul.
- L’épilepsie : la chirurgie en elle-même peut être pourvoyeuse de crises d’épilepsie. Ainsi, un traitement anti-épileptique « protecteur » est mis en place durant au moins les trois premiers mois suivant l’intervention.
- Un hématome ou une infection sont rares mais possibles, comme dans n’importe quelle chirurgie.
- La survenue d’une phlébite ou d’une embolie pulmonaire est également rare. Pour les prévenir, il est important de porter des bas de contention et de faire des injections qui évitent la formation des caillots sanguins.
Après l’intervention, quelles sont les précautions à prendre ?
Une IRM cérébrale est réalisée le lendemain de la chirurgie et permet de déterminer s’il y a un résidu tumoral ou non.
La période post opératoire est toujours une période de fragilité qui nécessite du repos et une surveillance attentive, d’abord en service hospitalier puis à domicile. Le patient reste à l’hôpital entre 3 à 7 jours puis rentre chez lui. La cicatrice doit être surveillée et nettoyée quotidiennement par une infirmière jusqu’à fermeture complète en 10-15 jours. L’arrêt de travail est d’au moins 3 mois. Des médicaments sont donnés systématiquement pour la douleur, qui reste modérée et disparait en quelques jours.
Les résultats de l’analyse de la tumeur sont généralement disponibles 3 à 4 semaines après la chirurgie. Le dossier est de nouveau discuté en RCP pluridisciplinaire et, en fonction de la présence d’un éventuel résidu et de la nature exacte de la tumeur, il peut être proposé de mettre en place un traitement complémentaire visant à diminuer le risque de récidive de la maladie.
Un mois après la chirurgie, le patient est vu en consultation de neuro-oncologie, pour l’annonce des résultats et pour définir la suite de la prise en charge.
Trois mois après la chirurgie, à l’issue de la phase de rééducation, une consultation de neurochirurgie, un bilan orthophonique et un bilan neuropsychologique sont réalisés.
Consulter aux HCL
- Service de Neurochirurgie crânienne générale, tumorale et vasculaire (Hôpital Pierre Wertheimer)
- Chirurgie éveillée : opérer avec l'aide du patient - Actualité
- Gliome de haut grade - Fiche santé
- Soins et spécialités - Rubrique
